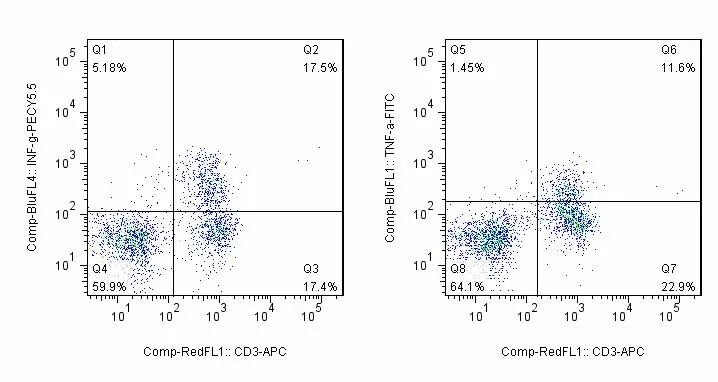
【实验方法】1. 对照管和检测管中均加入100μL肝素抗凝全血和100μLPRM1-1640溶液;2. 对照管加入3.4μL 1mg/mL的莫能星工作液,检测管加入5μL 1μg/mL的PMA工作液,4 μI 50 μg/ml Ionomycin 工作液和3.4 μl 1 mg/ml 莫能星工作液。3. 37 ℃,5% CO2 培养箱培养 4~6 h。4. 混匀,取出 100 μI,加入适量 CD3-APC,按照试剂盒说明进行孵育;5. 用破膜剂固定和破膜;
6. 加入适量TNF-α-FITC,INF-γ-PE,按照试剂盒说明进行孵育;
7. PBS洗涤,去上清,PBS重悬后上机检测。
【实验结果】
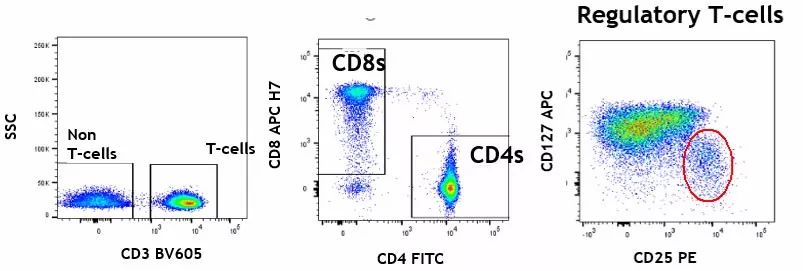
双阳性区域(Q2、Q6)为CD3+T细胞细胞因子分布。

【实验介绍】T淋巴细胞亚群根据TCR不同可分为TCR αβT细胞和TCRγδT细胞,γδT细胞可直接识别并结合Ag分子,无需与MHC分子结合,无需APC提呈,血液和淋巴组织中γδT细胞约占总T细胞的1-5%,其执行固有免疫防御(吞噬功能),类APC作用,并分泌IL-2、IFN-γ、IL-17等细胞因子等,与同等数量的αβT细胞相比,其分泌细胞因子的能力更强。
【实验原理】活化的γδT细胞能大量表达IL-2,,结核分枝杆菌低分子多肽抗原(Mtb)能活化PBMC,增值培养后能获得较高比例的γδT细胞,用佛波酯酸(PMA)和离子霉素(IM)活化γδT细胞,检测γδT细胞内的IL-2表达情况,从而表明γδT细胞的百分比。
【主要试剂】CD3-APC、CD8-PE、IL-2-APC-Vio770
【实验方法】1. 细胞制备:分离PBMC细胞,采用RPMI培养基进行活化培养,得到Mtb活化的T细胞(MtbAT);2. 细胞处理:1mL PBMC(MtbAT)中依次加入PMA(20ng/ml),IM(1μg/ml),BFA(10μg/ml),37℃、5%CO2条件下培养5h后收集细胞,PBS洗涤并重悬细胞;3. 混匀,取出 100 μI,加入适量 CD3-APC,CD8-PE,按照试剂盒说明进行孵育;4. 固定破膜:用破膜剂固定和破膜;5. 加入适量IL-2-APC-Vio770,混合4 ℃避光孵育30min;
6. 洗涤:PBS洗涤2次并重悬,流式上机检测。
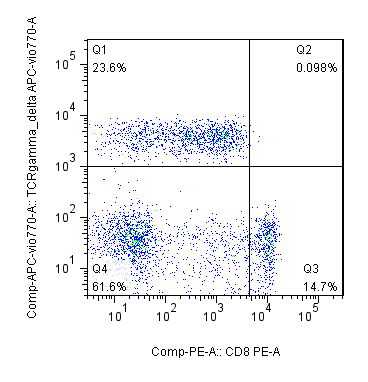
【实验结果】
下图Q1单阴性为TCRγδT细胞。

【实验介绍】自然杀伤细胞(NK)是一类不依赖抗体且无MHC限制的一类细胞,其识别靶细胞为非特异性,可释放穿孔素、NK细胞毒因子和TNF等杀伤介质,介导杀伤靶细胞,NK细胞活性可作为判断机体抗肿瘤和抗病毒感染的指标之一。在血液系统肿瘤、实体瘤、免疫缺陷病、艾滋病和某些病毒感染患者,NK活性减低;宿主抗移植物反应者,NK活性升高。
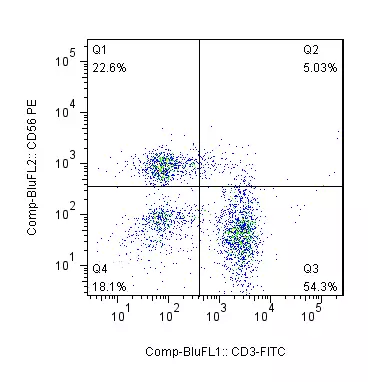
【实验原理】NK细胞细胞是一类表达80-90%的CD16和大于95%的CD56具有调节功能的免疫细胞,常联合CD16和CD56作为NK细胞的特异性标志,本实验以外周血作为对象,运用荧光标记的抗体与待侧细胞表面的标志结合,运用流式细胞仪检测特异性荧光信号,最终获得CD3-CD16/56+的NK细胞数量和比例等数据。
【主要染料】CD3-FITC、CD16+56-PE
【主要结果】CD3-CD16+56+为NK细胞群体