我是少女丹,开始写这封公告的时间是2016年11月30日,距离我昏厥被送往急诊的11月10日过去了20天。这期间我知道了一些朋友对我的留言关心,我现在还在治疗中,但不是绝症而且也没有生命危险,恢复健康只是时间问题,如果不尽快跟大家报个平安的话,我会惴惴不安。发生的事情密度非常高,我注意力集中会加剧头痛所以也就支撑得起每天写一点,发出来的时候应该至少是几天后了。如果只写概况,也许会有很多问题,来回回答会很累,所以我尽量在这里写完,前面是基本情况,后面是细节。
基本情况
11月10日的晚上,我在家处理公司的事,发邮件和微信,中途接了几个电话。后来我知道了,我在中途昏倒在地板上,全身抽搐,头持续向后撞击,发出类似哭喊的声音。等我睁开眼睛时,不知道发生了什么,头很重,意识模糊,试图站起来,也站不起来。距离我最近的医院是「和睦家医院」,我被送去了和睦家医院的急诊,立刻照了脑部CT并拿到了结果,以下医生我按见到的顺序用ABCD来标注。急诊值班医生A告诉我脑部有一个阴影,是什么不清楚,他不是专科医生,建议明天跟神经内科的专科医生确认。
第二天,见到了神经内科医生B,医生询问了发作的详细情况,哪些症状有,哪些没有,然后确认了以前有没有这样的发作,我说从来没有过,这是第一次。诊断这是「痫性发作」,但具体脑部什么原因引起的,CT片不够,需要做核磁共振MRI和脑电图EEG。感谢她的费心协调,当天就做了脑部增强MRI(MRI with contrast)。做完MRI在等结果,护士告诉我医生给她们打来电话,让我不用回门诊找她了,医生会过来找我说。
半个小时后,医生来了,把我带到休息室,跟我说她已经看了传过去的MRI片子了,看起来是有一个肿瘤。她停了一下,看着我。我说,知道了。那么这个肿瘤可以怎么处理?她接着说,大概率是良性的,手术就可以,不用立刻做可以观察它长大的速度。我问,是开颅手术吗?她说,是的。到此我知道了目前全部的信息,跟医生道谢后,我接下来的要做的就是神经内科和神经外科好的医院,分别诊断,然后尽快做完检查。北京神内神外科最好的医院应该是「天坛医院」,但这所公立医院非常繁忙,另一个信息是其中有一部分「天坛医院」的专家也在和天坛医院合作建立的医院「天坛普华」出诊。为了快,接下来的几天我就在这两所医院来回。
天坛医院神经内科专家C看完当前资料诊断结果如下。医生B认为肿瘤的地方医生C认为是囊肿,好消息。这次「痫性发作」的原因他认为不是这个地方引起的,有脑膜炎的可能,坏消息。有明显「海马体变异」,坏消息。完成检查需要住院7-14天。
做了肿瘤检测目前最先进的PET/CT技术。
做了腰椎穿刺,取了脑脊液送去「协和医院」检查,测了颅压高于正常值较多。
然后连续抽了十几管血,结果还没有完全出来。
12小时脑电图接着24小时脑电图,都没有抓到能证明癫痫的特征波棘波。
检查结果是由「天坛医院」和「协和医院」共同出,现在已经拿到大部分。剩下的顺利的话也会在两周内拿到了。天坛医院神经内科专家C、天坛普华三位医生会诊看了已经拿到的这部分材料,四位都是神经内科的医生。目前的结果总结起来是:
- 单次痫性发作。初期判断跟癫痫反应类似,但两次脑电图都没有抓到癫痫的特征「棘波」。因此判断为急性发作,器质性原因不明,情绪性诱因是当天情绪激动。总结起来:暂不能诊断为癫痫,如果再次发作需立刻住院。
- 海马体病变。可能是导致这次痫性发作的器质性原因,如果之后不引起其他并发症就不处理。
- 左侧有囊肿。
- 颅压250,高于正常值90-180较多,原因不明。
照我的理解,神经内科医生的意见认为是不发作就休息,再次发作就住院。另外等得到全部检查结果后我也会递交给天坛医院的神经外科医生,如果剩余检查结果没有跟之前的结果相悖,那么就可以确定:
目前不用动手术。
10号这天昏厥我完全没料到,由于毫无准备被吓到了。其他的,医生告知我脑部肿瘤也好,剧烈头痛快一周不能起床也好,发现新的脑部问题也好,身体上不太舒服,但我心情上一直平静。有一部分原因是心里隐约知道。往回倒几个月,我每天书包里就背着一包药,周围的好些人发现我不仅完全放弃了喝酒,我开会前喝咖啡的习惯也停了。去医院的频繁程度就像零件轮番报废的机器人,好多次都是拿了药就从医院直接去工作地点。有投资人发现我比以前瘦了很多,并且脸色苍白,其实就是因为我很痛。六月份时其中一个肿瘤指标高于正常值3倍,根据我有限的医学知识也知道这有可能提示有问题,当然也有可能什么事都没有。了解这一年我病情的医生催促我住院,不能头痛医头脚痛医脚,拿了药就走了。我也很想停下来解决一下身体的问题,不要再连夜工作透支了,但我当时觉得比较负责的方式是,把融资解决后保证公司资金充足,然后再找到合适人选替代我做CEO,不合适的人员辞退和补位处理完毕。然后我就去住院。
在10日之前,我竭尽全力做着这些事。10日的突发病倒后,接连发生很多事,其中最容易猜到的,就是在确认我不是装病而是真的病倒了,因而短期没办法管理公司的时候,我的公司会易主。看起来我最重要的价值就是:持有一家市场估值2-4亿的公司超过60%股份。在病倒前,公司发放工资的钱已经不足,另外,由于用户使用支付宝交易需要手续费,而空空狐是由平台方来垫付这笔费用,已经支付金额200万,现在是在用用户的交易流水金额来周转,如果用户集中提现,那资金链必定出现危机。我跟股东提过,就算是让我拿持有的所有股份作为交换,只要对方能保证我的员工的工资和社保公积金不受影响,用户能正常提现,我愿意接受。
在听的人看来,这也就是说说而已,谁会放弃。10日病倒后,除了「员工和用户的利益不受损」,「我要安心治疗不再受到刺激」也加入了我的目标清单。现在我已经接受了一切针对我的苛刻条件,执行的律师说这是他负责修改过的最伤感的协议,但换来了公司正常运行。
我病得突然,昏倒前都在高强度的工作,股东和离职高管刚开始不相信我会突然病倒,直到他们通过各自的方式确认了。在病中,我出去参加了一次会面,强打精神出去的原因回想起来很伤感,当时我只有出现在现场这一个办法,才能避免他人以我的名义去借钱……
签署了0对价转让股份协议后,股东担心我病好以后会反悔,因此跟代表我的委托人反复确认。现在我好一些了,意识也清醒,就对股东说一下:我签署的合同我就会遵守。
以下是细节
以11月10日为分界线。
10日之前的内容是背景介绍,关于公司是干什么的、我平时在干什么、股东和离职高管在干什么。
11月10日之前
有些朋友知道我,是因为工作宣传出现在电视节目上面,我是一家小公司的CEO,但具体是干啥的,我自己很少在微博说。一方面是因为在电视媒体这些地方为公司宣传嘻嘻哈哈的我已经精疲力尽了,微博我想做自己。另一方面也是因为关注我微博的朋友并不是我产品的核心受众,所以从现实层面上来说也完全没必要。
小部分早期关注我的粉丝是知道的,我创立的就是「空空狐」,女生用的二手交易平台,2016年业内比较权威的第三方统计机构「易观中国」发布的二手平台排名,前三的是阿里集团旗下的「闲鱼」、58赶集集团的「转转」和「空空狐」。各位可能在微博上看到过我们投放的广告,男生的话,如果用过「闲鱼」,那也容易理解,就相当于女生版的,交易衣服、包包这些闲置的。这是我的团队2014年9月发布的产品。
这是个毁誉参半的交易平台APP,被喷的常见情况是一个用户被另一个用户坑了,平台方却只能通过平台上双方的聊天记录订单记录来判定,而平台以外的证据,比如微信聊天记录我们没有能力判定真伪,因此可能被认为偏袒了买方或者卖方。这种被骂是很正常的,也是作为平台应该承受的。
另一种常见情况是,用信用卡套现被判定为异常用户后,会加入灰名单,这些用户申请提现之后会被冻结然后延期提现。正常用户仍然是在三个工作日内完成提现。信用卡套现的人不能及时套到现,就组队发帖,大意就是「平台空空狐拿钱跑路」,负面新闻也许可以引起大量用户恐慌,平台就可能顾忌名声或者融资提前跟他们妥协。
两种情况基本覆盖了空空狐的负面新闻类型。
从资本价值来说,公司估值从第一轮5000万,到第二轮2.8亿,到第三轮进入资本寒冬,也就在3-4亿之间。第一轮是红杉资本(Sequoia Capital)领投的,第二轮是上市公司昆仑万维的董事长周亚辉领投,红杉资本、源码资本等机构跟投的。
两年前刚开始跟风险投资机构打交道的时候,看到身边风险投资机构跟其他公司签了Term Sheet(投资框架协议)最后反悔,导致这些公司错过跟其他机构的谈判机会,我都觉得惊讶。因为投资框架协议仅单方面限制公司接触其他投资人这一条有法律效应,对投资人没有限制,所以从法律上来说投资机构这么做是没有问题的。后来我第二轮融资的时候,公司和投资人签署完具有双方约束法律效应的SPA(正式投资协议文件),一起给媒体提供了融资信息后,投资款最终照样没到齐。
如果问我,既然都有法律约束,为什么不能让签署协议的股东打钱?而且我这件事从来没有公开说过。为什么呢?因为太危险了。诉讼,就算真的有希望,需要的时间是几个月还是一年没人能预测,在那之前公司很可能就没有资金运转了,所以我至今还没看到有人敢这么做。除此之外,这样做本身就意味着跟股东公开撕破脸。引用股东源码资本的合伙人曹毅在一次电话会议上跟我说的话:
「你还想不想在圈子里混了?你公司还想不想以后融资了?」
我的诉求很明确,就是业务已经汇报了,公司快没钱运转了, 你们的钱啥时候打?如果有什么疑虑的话,是毁约吗?确定毁约的话直接告诉我,不要反复开电话会议找理由了,已经几个月了,我们得明确废弃之前的合同,我才能赶紧寻找投资人给公司续命啊。要不然公司有上一轮的投资合同束缚,股东应付投资款又不到账,就连新一轮投资人问我们上一轮的确定的融资额到底是多少都不能回答,上一轮投资没结束的情况下,下一轮没办法进行。
好几次快要发不出工资,我焦头烂额为了钱到处跑,但同事们并不知道有这么多次危机,因为无论如何我还是按时在每个月10号发出了,没有耽误过。
从去年8月份接下来的一年,公司的投资款到底会到账多少,我也不知道,因此预算起伏变化。股东先是催促我快速增长业务,也就是增大市场投放花钱,几个月后改成告诉我停掉市场投放,是停掉噢。如果我这次仍然这么执行,那么就相当于放弃接下来的融资了。之前一轮的投资款还没有到账,又损失掉下一轮融资的希望,这样谁来负责呢。当我这样回问股东的时候,没有得到答复。
最后第二轮的投资款加起来总共3400万,并且按照这个数字重新修改了协议。此前红杉投资人介绍了闲鱼的运营负责人季诺来空空狐担任COO,周亚辉支付给COO 300万,这笔钱由于是周亚辉直接支付给COO的,公司账面上没有呈现。但钱是算在投资款里。也就是说,公司运营实际收到的钱是3100万。除此之外COO年薪税后200多万,税前公司支出的钱超过全公司的所有人的工资总和。
COO的薪资支出超过全公司总和,支出太不合理了,因此我每次都要回答未来投资人对薪资结构的质疑,而且以后引进的其他高管怎么办,薪资不可能一直这样下去。所以我早晚得按照高管的市场薪资把这个支出降到合适范围,比较保险的方案是,在公司新融资到账后,再决定COO的降薪,这样即便有离职风险,也不影响全体员工的稳定性,这个职位也有足够的时间来补位。跟计划不同的是,融资还没敲定的时候,资金已经很紧张,如果这种时候给COO降薪,最大的可能就是COO离职,而离职进而证实了公司资金危机,那么也许等不到融资谈妥就员工动荡投资人退缩了。如果不降薪,下个月的工资发不出来了。没有哪个方案是好的,我选降薪续命。
那段时间,除了跟投资人,我几乎完全不说话,实在太累了。白天去投资机构开会,晚上更新机构不断新增索要的业务数据文件到凌晨。基础数据、留存分析、复购分析、融资后市场计划、预期用户增长根据、财务预测……
COO没有提前跟我说,直接邮件抄送HR要离职。这时候公司正在查处信用卡套现,一边联系支付宝提供我们监管的记录,另一边第三轮融资已经见完所有合伙人,数据尽调也做完了,到了最后阶段。
11月10日
11月10日发生了两件事。
第一件事,10号是每个月发工资的日子。
我的个人存款全部垫付公司支出以外,员工的工资缺口45万是我前一天晚上飞回重庆借的。为了不延迟发工资,还没来得及赶回北京我就先把借的钱打到了公司账户上。COO是除我之外唯一一个没发工资的,其他同事的工资都发了。
第二件事,COO打电话给我。
由于借的钱不够,把我和COO从发薪名单里面去掉,先发其他基础员工的工资,我和COO的工资在公司融资到账后补发。几分钟后,我就接到COO的电话,但这一次威胁我也没有用了,其他员工的工资是我个人借钱发的情况下,当时没有钱发给他。接着COO说,让我立刻给他盖章办离职证明,要不然就在公司闹。高管离职我得通报董事会,通过了才能给COO办,我没有权力独自同意,两个董事,红杉的董事郑庆生我今天就可以联系到,但另一个董事昆仑万维的董事周亚辉据说在美国,可能需要一两天的时间。我把这个情况说了,COO在电话笑着说你骗谁呢你盖个章就行。这个电话挂掉就一直打进来,我把详细情况写成文字汇报给董事会,红杉董事郑庆生很快有了回复,「不要影响公司融资,给COO开离职证明让他走。」周亚辉没回复。我打电话回公司执行这个决定。
在当晚7点左右,我昏倒失去意识,被送到急诊。
11月10日以后
不知道突然什么时候又会失去意识,我委托了一位创始员工代我执行公司的事。第二轮领投的股东「昆仑万维」的董事长周亚辉提出,由「昆仑万维」接手「空空狐」,承诺是由「昆仑万维」给公司注资500万(签署协议并派遣指定CEO任职后即注资200万),保证员工社保公积金正常缴纳和用户的提现正常不受影响。条件是创始人将股份无偿转让给「昆仑万维」,最后创始人的股份由60%多变成10%。这显然不是一个像之前两轮那样的正常估值的融资,但我已经没有什么谈判的筹码。
摆在我面前的路有三条:
1. 把老股东的投资款要齐。
不可能。要了一年都没有要齐,何况在公司困难的情况下,股东就更不会到账了。
2. 第三轮新投资人的融资打入公司。
虽然到了最后阶段,但负责以后业务规划的创始人突然生病了并且不知道什么时候能够复工,这种消息足以让融资泡汤。
3. 先借钱把危机撑过去。
维持公司人员开支和用户正常提现大概需要200万,这个数字也许借得到。但这之后仍然要把第三轮的新融资打入公司,如果办不到,那之前借的所有钱也就都白费了。拿到第三轮新融资现在出现的变数,就是我生病了。如果告诉新投资人我几个月后就会好,就会回到公司,一方面这么说完全没有根据,另一方面员工的公积金在当月25号之前必须交上。员工的五险一金一旦断掉,公司里计划购房购车的员工该怎么办?
所以我没有再去借钱。当时有人提出只需要借钱把公司这段撑过去,然后即便低价出售公司,3亿的公司也得卖个几千万,我的收益也是过千万,而提出方案的人也想从中分得利益。我拒绝了,说拒绝都不够准确,应该说是以关系破裂为代价阻止了这个做法。
对我来说,公司既然都要易主,我自己有钱当然比没有好,但是这个方案如果失败,员工的五险一金就断保了……
以前我跟投资人争执,从不会跪下低头。但这次我负担着整个公司员工的利益,在这种时候,我是很干脆的跪下的。接受「昆仑万维」的条件是当时最稳妥的办法。
基本已经讲完了。
11月28日,转股协议签署、新CEO接任、公司注资200万。在合同最后签署之前,周亚辉把由「昆仑万维」接收股份改为由他个人来接收,所以在工商变更后的「空空狐」的90%股权持有者变更为周亚辉。
我丧失董事会席位,因此接下来实际上给我剩下的10%股份也是可以通过类似这次的远低于市场估值的融资来稀释到0.1%或者更低,所以这个股份就相当于没有。
股权、董事会席位我都不需要,我离开后,公司应该按照员工入职时间计算创始员工的期权。这个后来被模模糊糊的绕过去了,方式就是告诉我们写着创始员工入职时间的员工协议找不到了……
我尽力了。
「空空狐」还在,部分员工离职,新派遣的CEO已经接管公司一段时间。
如果接下来公司被出售,我剩下的股份有「一点点」的可能性变现,那不论多少,我都不要,全部按照当初的比例给创始员工补偿他们。
这三年里,我犯了不少错,承受不住股东压力盲目增大市场投放、引进高管过程中考察不全面、忙于对外融资对内把控团队不足……每一个错误环环相扣走到了现在的失败。但我也成长得比以前任何时间段都快,这三年是我和世界交涉的一个开始,未来我还有很多想实现的事。我不再是CEO,也没有存款和房子,暂时回到父母家里休养。谢谢关心我的各位,我身体在恢复,Westworld第一季也看完了。

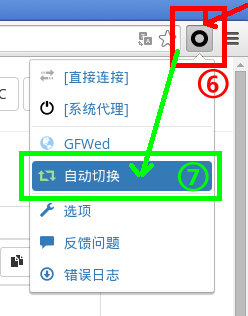
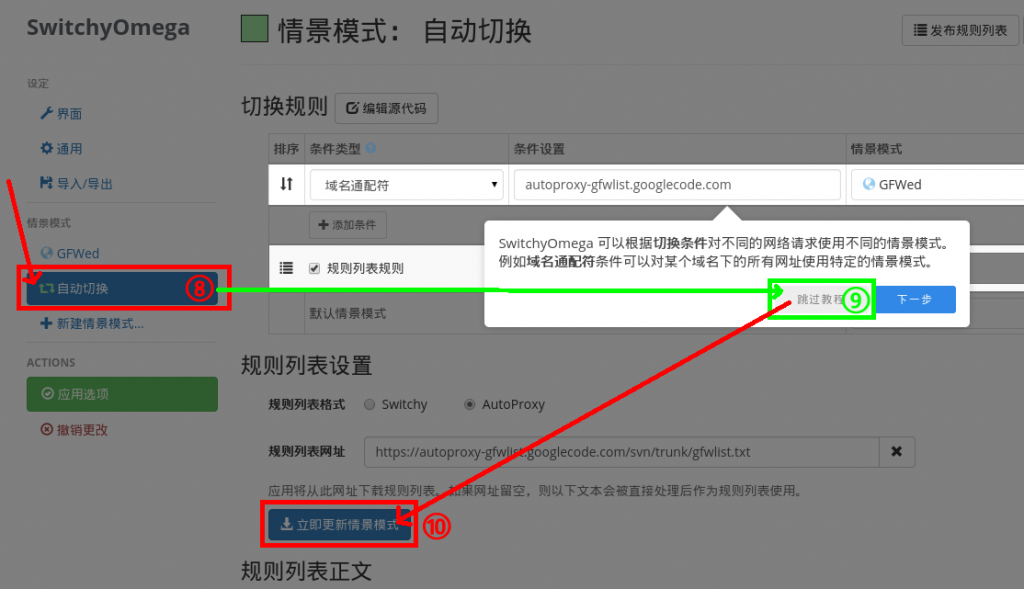
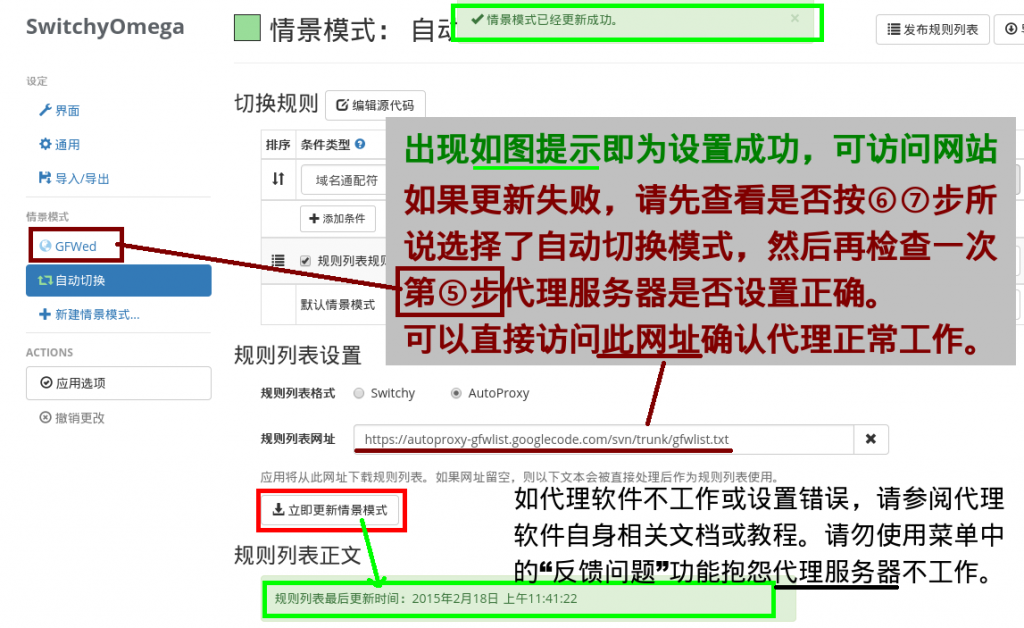
 。(阅览教程与否不影响接下来的步骤。)
。(阅览教程与否不影响接下来的步骤。)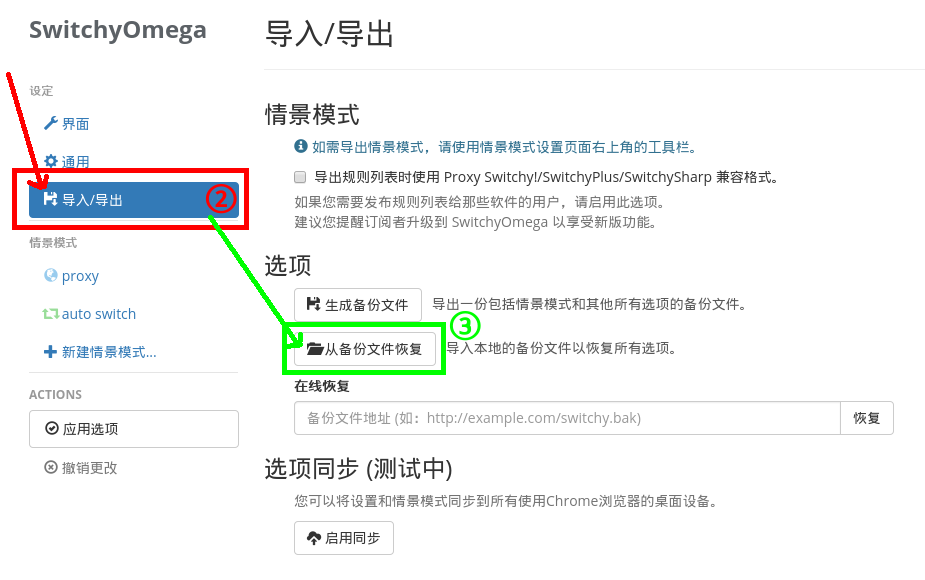
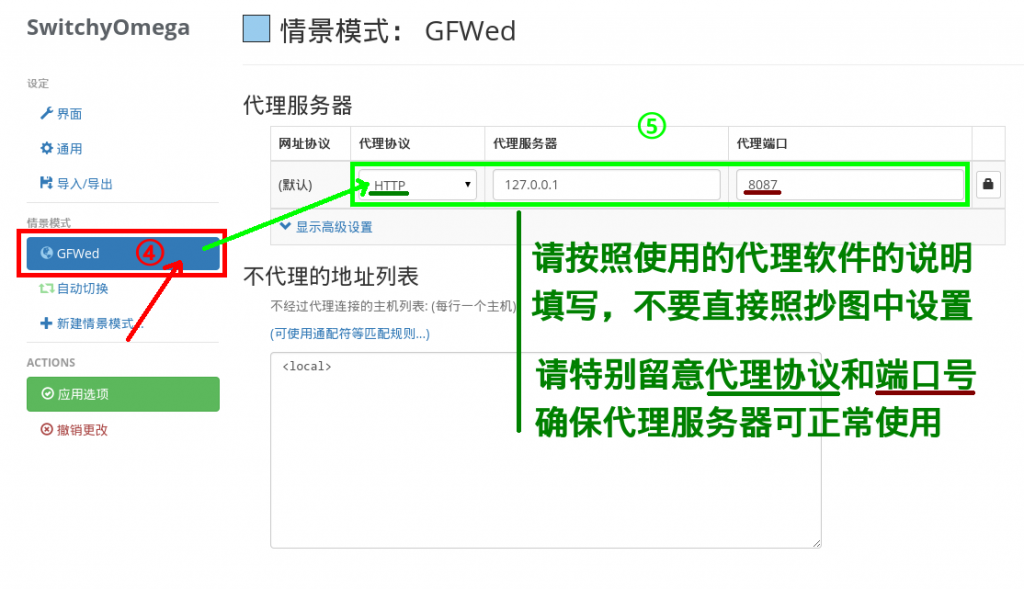
——配置chrome插件switchyomega.png)