Cell therapy
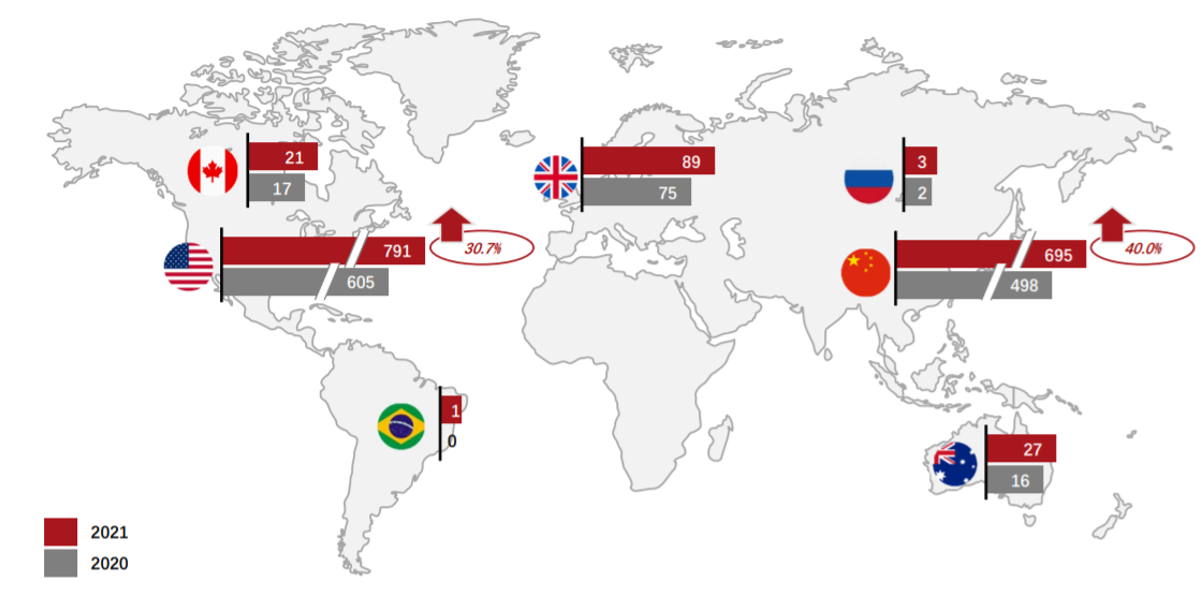
#Global Cell Therapy R&D Pipelines Development
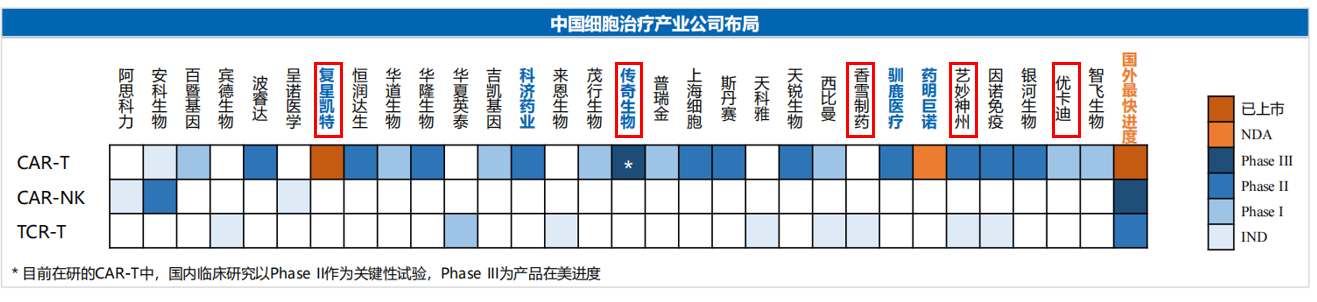
#China Cell Therapy Companies Layout
1,Approved by NMPA:
- Jun 2021 FosunKite(复星凯特)CD19 200K USD;
- Sep 2021 JW Therapeutics(药明巨诺)CD19 200K USD
2,Aurora/NL Users:
- FosunKite(复星凯特)
- Unicar-therapy(优卡迪)
- ImmunoChina(艺秒神州)
- GracellBio (亘喜)
- Xiangxue Pharmaceutical(香雪制药)
- LegendBiotech(传奇生物)
#Cell Therapy Market Trends
- Car-NK:B-ALL, Breast Cancer, HCC
- TIL :Melanoma, Cervical cancer
- TCR-T: Melanoma, sarcoma
- γδ T
- Crisp- Car-T
- Car- Treg
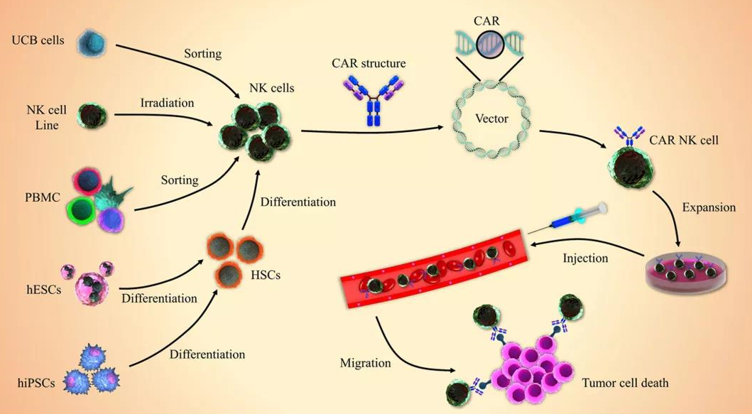
#Car-NK Potential Advantages
1,Better Safety
No GVHD and low CRS
2,Keep natural anti-tumor cell toxicity
NKp46、NKp44 and NKp30
3,“universal” product potential
From PBMC, UCB, HESC, IPSC
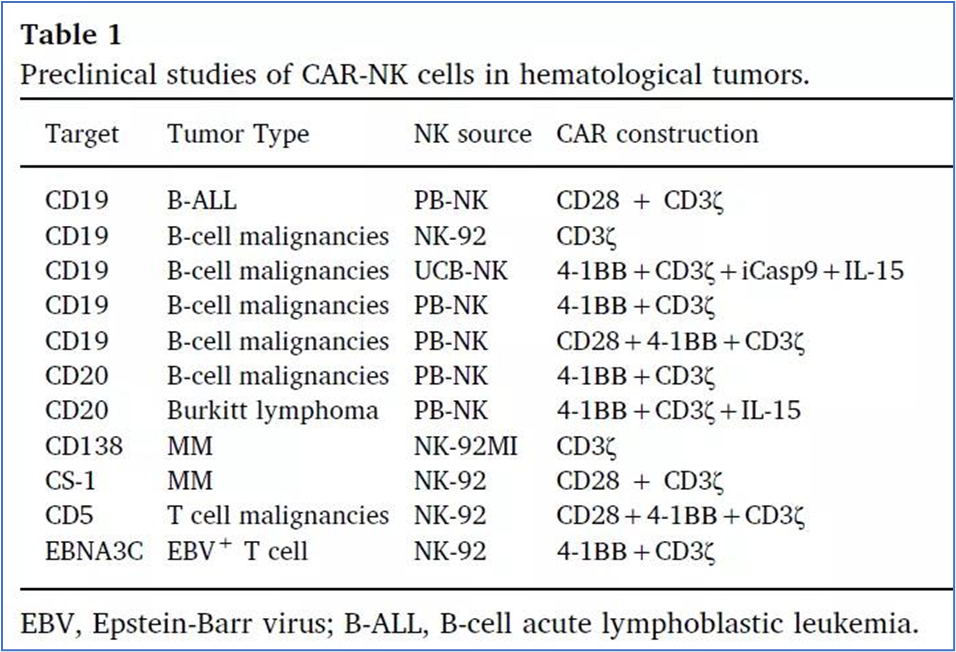
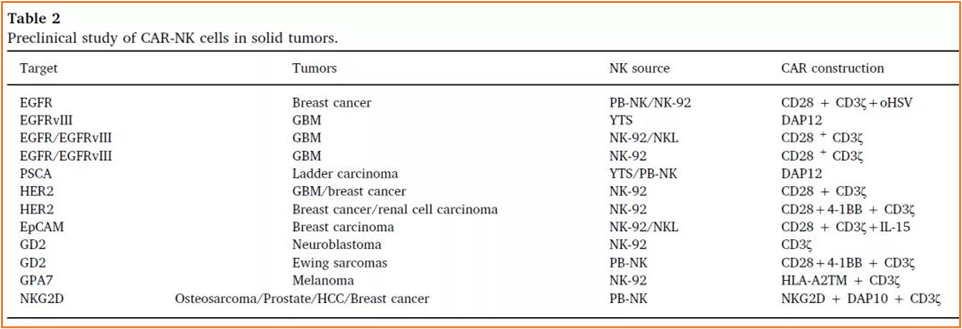
#Car-NK Targets in Hematological and Solid Tumors
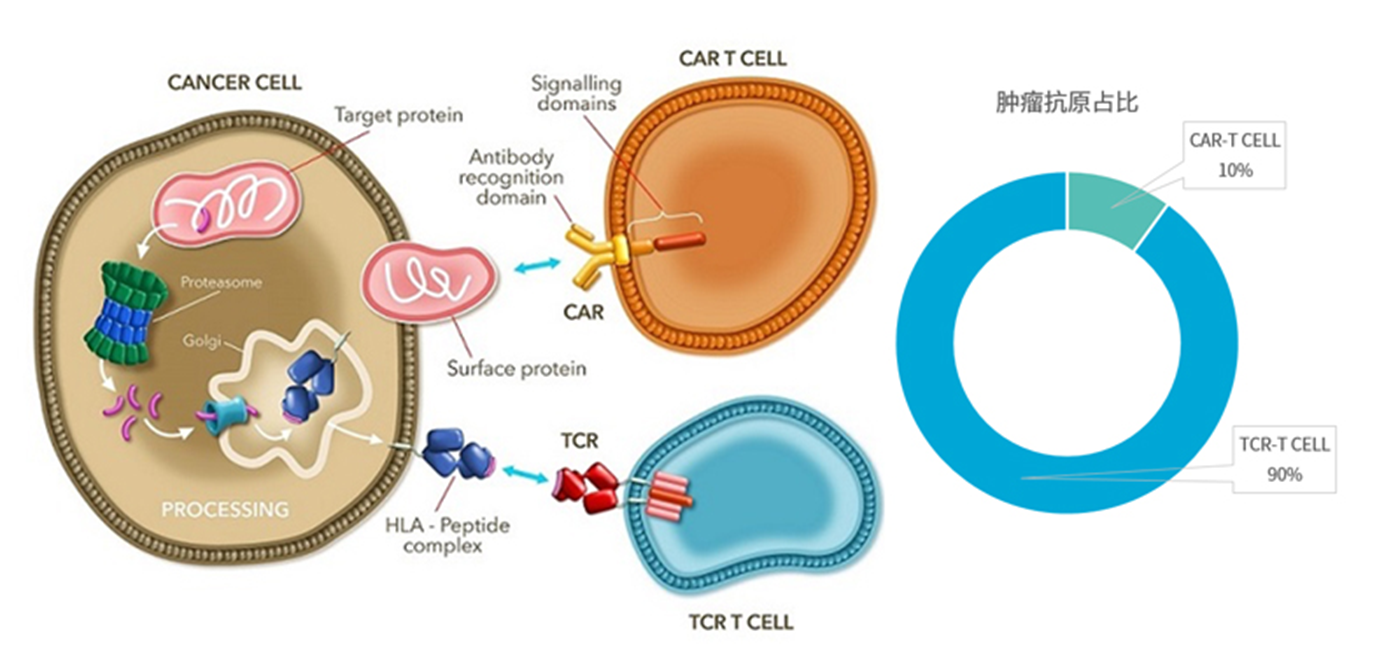
#TCR-T for Solid Tumors
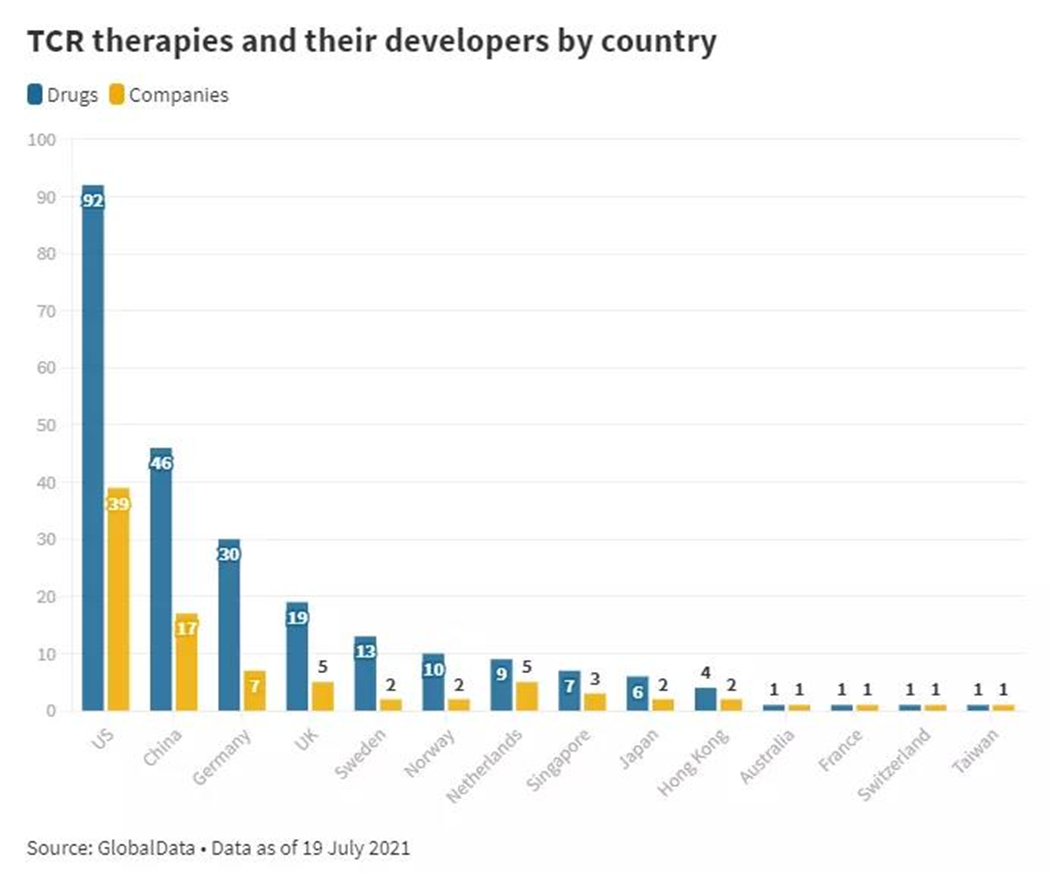
#TCR-T develop rapidly in 2021
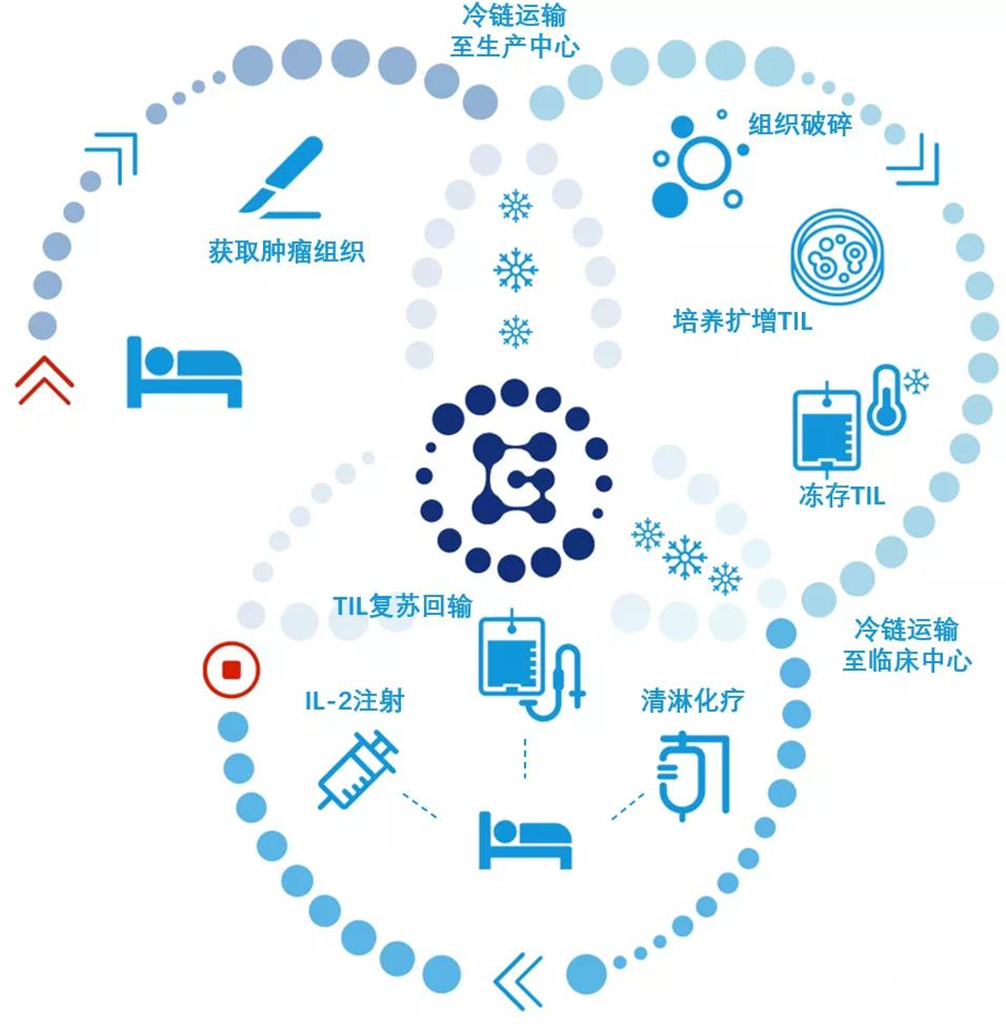
#TIL Advantages in Solid Tumors
- Good tumor invasion
- Targeted non-selective, tumor-specific killer T cells
- Specific recognition of tumor antigens only
- No genetic engineering, cost saving
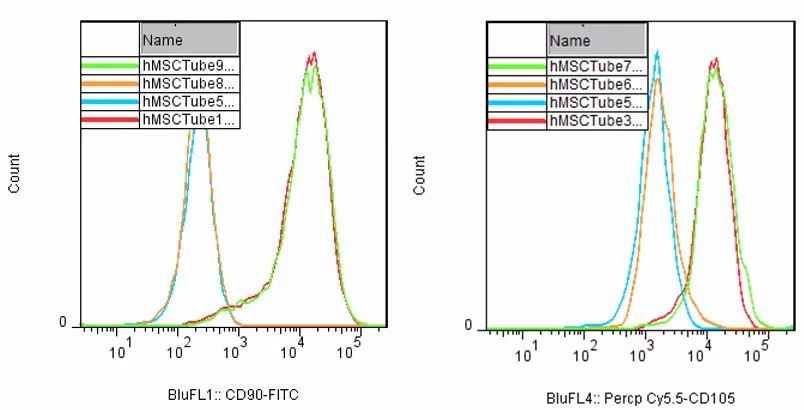
#Flow application in cell therapy
- Immune therapy biomarkers screening and evaluation
- Cell therapy products evaluation
- Patients immune function determination
- Monitoring MRD
#Immune therapy biomarkers screening and evaluation
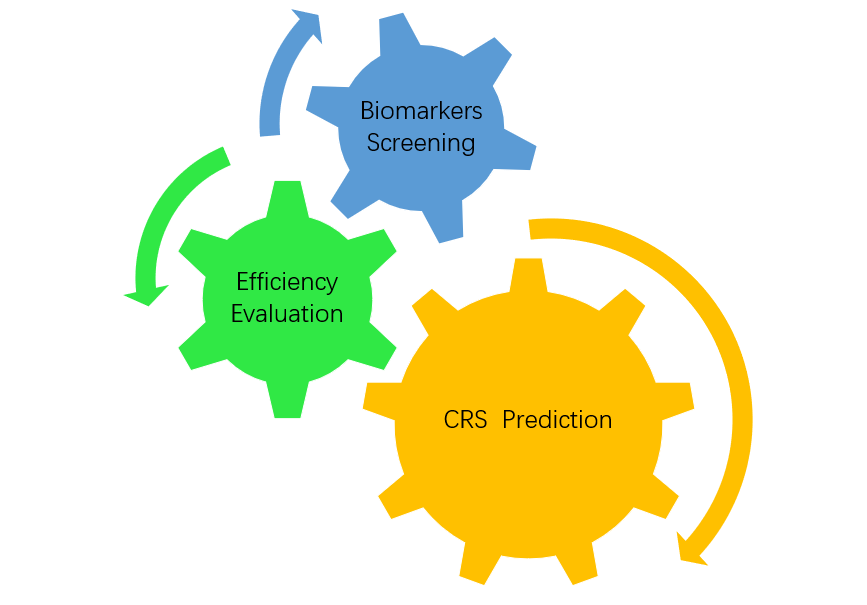
#Cell therapy products evaluation
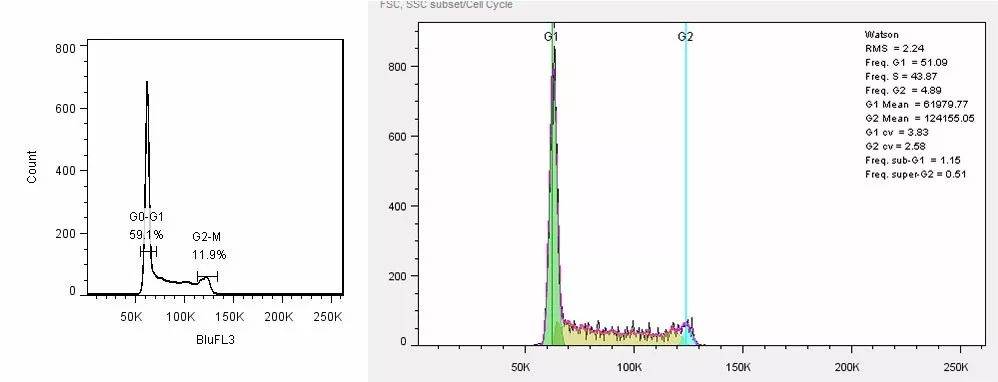
- Evaluation of transfection efficiency
- Knockout efficiency evaluation
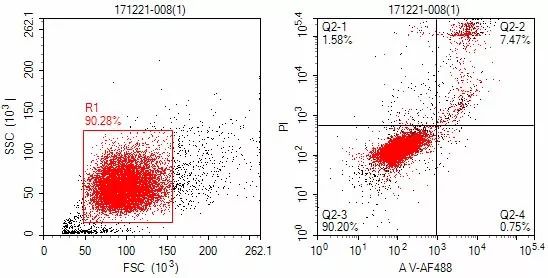
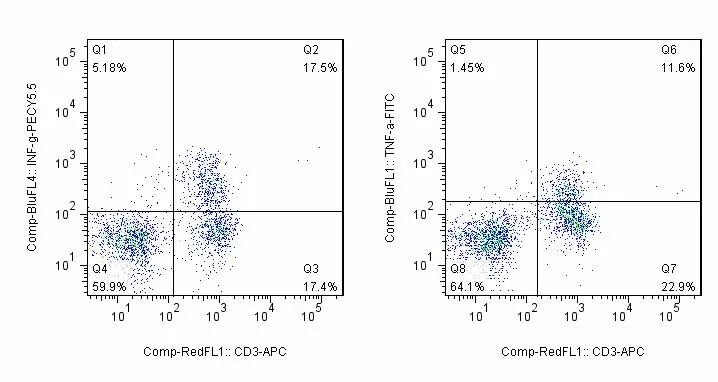
- Tumor killing effectiveness evaluation
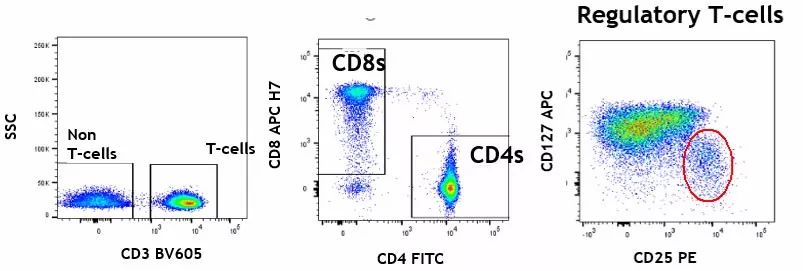
#Patients immune function determination
- Immune function database
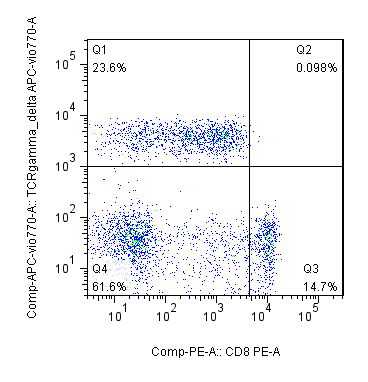
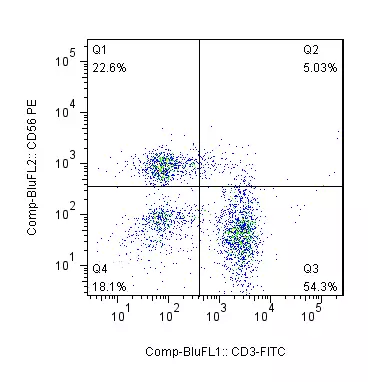
- TBNK population
- T cell subsets —— dynamic observation
#Guiding Opinions for Clinical Trials of Cellular Immunotherapy Products (Trial)
| Test Items | Platform | |
| PK | VCN, Virus Vector Copy Number | qPCR/dPCR |
| Car+ cell number | FCM | |
| PD | Cytokine | ELISA/FCM |
| Immunogenicity | Drug resistance antibody, ADA/HAMA, Anti-Drug Antibody | ELISA/FCM |
| CTL, Cytotoxic T- Lymphocyte | FCM | |
| Safety | RCL/RCR Replication Competent Lentivirus | qPCR |
| Virus integration site detection | NGS | |
| Lentiviral p24 protein detection | ELISA | |
| Car-T cell phenotyping | Lymphocyte subsets, TSCM | FCM |